经皮二尖瓣置换技术-路在何方
二尖瓣反流(MR)是西方世界中最常见的瓣膜病变,欧美流行病学研究数据显示,75岁以上人群中,MR罹患率高达10%以上,明显超过主动脉瓣膜病变。同样,随着我国人口老龄化病变进程的加重,二尖瓣反流病变也将导致沉重的医疗负担。传统的外科二尖瓣修复术或置换术是MR治疗方法的金标准,但约49%的MR患者因为心功能低下、合并症多、高龄等因素导致手术风险过高而未能接受外科手术,此部分患者迫切需要一种创伤较小的治疗方法作为替代方案,介入二尖瓣治疗技术应势而生并快速发展,为MR患者带来了新希望。MR介入治疗技术可以分为两类:一类是经导管二尖瓣修复术,另一类是经导管二尖瓣置换术。
经导管二尖瓣修复技术
在过去的十年中,几种由不同外科术式衍生而来的经导管二尖瓣修复技术已经出现,并用于治疗手术高危或无法手术的患者。经导管二尖瓣修复“工具箱”正在迅速扩展,欧洲已批准多达5种设备应用于临床(CE mark),包括 MitraClip (Abbott Vascular – 缘对缘瓣叶修复), the DS1000 装置 (NeoChord, Inc,介入人工腱索修复), the Carillon (Cardiac Dimensions, 经冠状静脉窦瓣环成型装置), the CardioBand (Edward Valtech Cardio,介入二尖瓣成型环)。
在目前的临床实践中,经导管二尖瓣修复使用的装置主要是模仿Alfieri提出的修复的MitraClip装置,自2003年MitraClip推出以来,已有超过100,000名患者接受了治疗,并先后获得CE,FDA及我国NMPA批准。
经导管二尖瓣置换术
虽然目前研究进展较介入修复技术较慢,经导管二尖瓣置换术(Transcantheter Mitral Valve Replacement,TMVR)理论上仍较经导管修复有着先天的优势。考虑到二尖瓣疾病的复杂性和异质性,研制一种经导管二尖瓣修复装置适合治疗所有二尖瓣病变解剖类型和风险水平的患者有着极大的挑战。
目前TMVR产品的研发是整个结构性心脏病介入领域竞争最激烈的领域之一,其技术的发展也十分曲折,经历了诸多的失败与挫折。前期的大部分产品因高死亡率、高并发症发生率等因素而停滞,据相关文献考据,目前有超过33种经导管二尖瓣置换器械问世,2012年开始,其中14种产品进入人体实验,瓣膜也尝试了各类不同设计理念,输送系统也从早期的经心尖途径逐步拓展至更加微创的经股静脉途径,截至目前,各类TMVR产品的不同试验人群总数达700名患者,其中雅培的Tendyne凭借优异的临床数据,获得了欧盟CE认证,使得这个领域迎来了久违的里程碑式的突破。
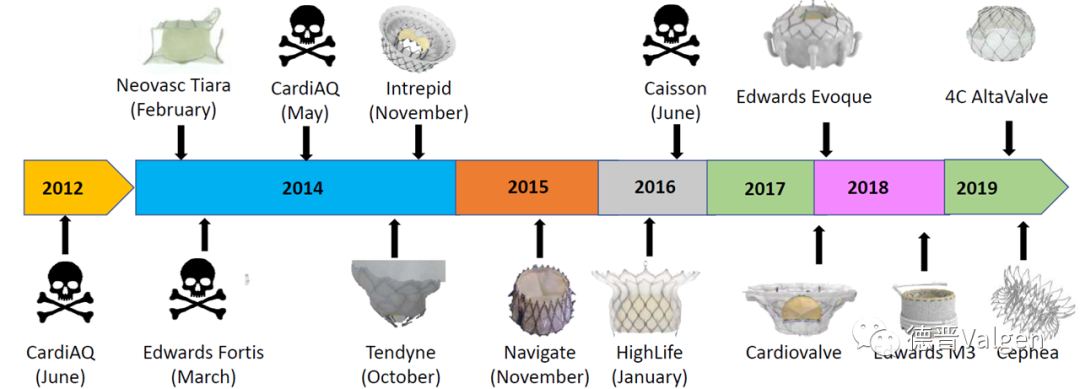
图1. 部分进入到FIM阶段的TMVR产品
2012年以来做到FIM以后阶段的TMVR产品达数种,目前获得CE认证的仅有Tendyne,进行美国大规模临床研究的也仅有Tendyne及 Intrepid两款瓣膜,而公司公布研发失败的瓣膜已有四款,有一些早期产品虽然没有公布最后研发是否成功,但临床研究已经停止不前,足以证明这个领域巨大的挑战及蕴含的机遇。

图2. 目前全球FIM应用数量统计
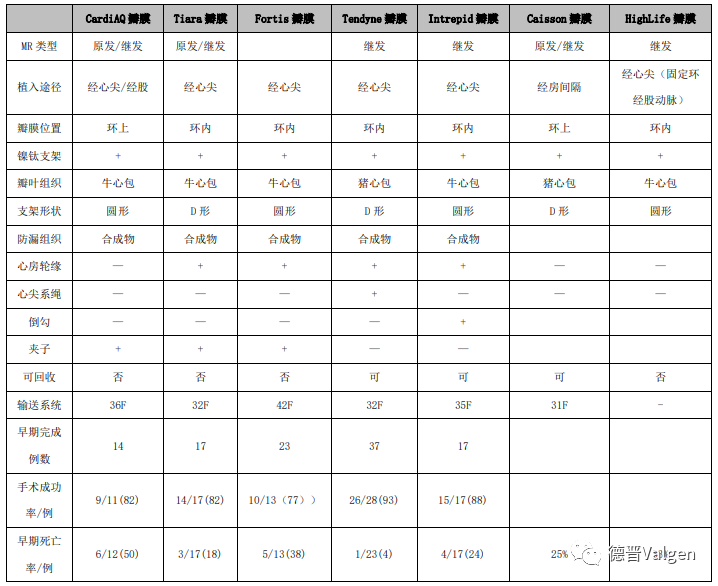
表1归纳了多种瓣膜产品特点和早期试验结果,包括:CardiAQ瓣膜、Neovasc公司的Tiara,Fortis瓣膜、Medtronic公司的Intrepid瓣膜、Abbott公司的Tendyne瓣膜以及Cassion瓣膜和Highlife 瓣膜等。
表1:各种瓣膜的设计特点以及早期临床试验结果
以下重点介绍几款二尖瓣置换产品
Edwards Lifesciences
CardiAQ 瓣膜是第一个二尖瓣置换瓣膜,由自膨式镍合金支架及牛心包材质的三叶瓣组成,动物试验评估了CardiAQ的可行性与安全性[1]。该瓣膜初始设计为经房间隔路径。2012 年在丹麦完成第一例人体 TMVR,尽管瓣膜功能良好,该患者 3d 后死于多器官衰竭[2]。在2012年和2014年各进行了First–in-man的研究,但皆因手术高死亡率和高并发症发生率试验被叫停。2015 年,Sondergard[3] 等对三位严重二尖瓣反流伴 NYHA 心功能Ⅳ级的外科手术高危患者实施经导管 CardiAQ 置入,结果显示 3 例患者全部成功准植入了 CardiAQ 装置,术后二尖瓣反流立刻缓解。两位患者术后恢复良好出院,术后 1d、30d、60d 的经食道超声心动图提示瓣膜功能良好,另一位患者术后第 9天时死于肺部感染。
2015年,Edwards Lifesciences公司4亿美金收购了CardiAQ 瓣膜,重新进行了临床试验,2016年美国经导管心血管治疗学术会议公布的早期临床研究结果显示,CardiAQ瓣膜植入患者的术后30d死亡率高至50%,因此该研究再次被叫停,CardiAQ瓣膜再次宣告失败。但是CardiAQ几起几落之后,故事没有就此结束,2018年Edwards Lifesciences推出了CardiAQ全新的设计版本,并更名为Evoque,同时完成了20多例的植入,长期效果依然不明朗。图3展示了CardiAQ 的各阶段瓣膜设计版本,图4是Evoque经房间隔输送系统。

图3. CardiAQ各个阶段瓣膜设计版本

图4. Evoque经房间隔输送系统
Edwards Lifesciences另外一个技术方案是研发设计了经心尖路径的二尖瓣植入器械Fortis 瓣膜(图5),是由牛心包缝制的自膨胀式瓣膜,组成包括牛心包瓣膜、镍合金的自膨式支架以及锚定系统。Fortis 瓣膜2014年8月启动FIM,至2015年3月 累计植入20余例,在2015年美国经导管心血管治疗学术会议公布的植入Fortis和CardiAQ瓣膜患者的术后30 d死亡率为25% ~38.5%,在2016年美国经导管心血管治疗学术会议公布的早期临床研究结果显示Fortis瓣膜植入患者的术后30 d死亡率高达38%,该临床试验也被叫停。
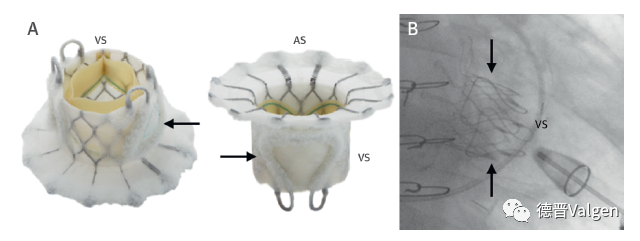
图5. 经心尖路径Fortis 瓣膜及X射线下影像
几次折戟之后,Edwards Lifesciences基于球扩式瓣膜Sapien3在主动脉瓣的成功应用,利用Valve in Valve技术的概念,推出了Sapien M3二尖瓣置换瓣(图6),该瓣膜由一个29mm的Sapien M3瓣膜和一个瓣膜锚定结构组成,瓣膜锚定绕过瓣叶,收紧后将置换瓣膜固定,目前已经植入40余例,30天死亡率为零。


图6. Sapien M3二尖瓣置换瓣
Neovasc
Neovasc的Tiara 瓣膜系统由自膨式镍钛合金框架和牛心包三叶瓣组成,心房部分裙边为“D”型以适应自体二尖瓣环;目前有35mm、40mm两种规格,通过 32F 输送系统经心尖途径置入瓣膜(图7),且不可回收。Tiara系统首次临床应用是2014 年1 月[4],紧接着2014年7月 CardiAQ状告Neovasc 侵权,Neovasc早期是CardiAQ的供应商,Neovasc最终在2017年赔付了CardiAQ7000万美金。然而经心尖路径Tiara瓣膜19 例患者接受治疗,技术成功率为84%,16%患者发生装置脱位而转开胸手术,30d 全因死亡率为16%[5] 。在TIARA-I和TIARA-II的研究中,入选48例患者,围术期和随访显示术后30天全因死亡率为8.5%,30天内心源性死亡率6%。经房间隔路径Tiara瓣膜(图8)目前还处于实验室研究研究阶段。
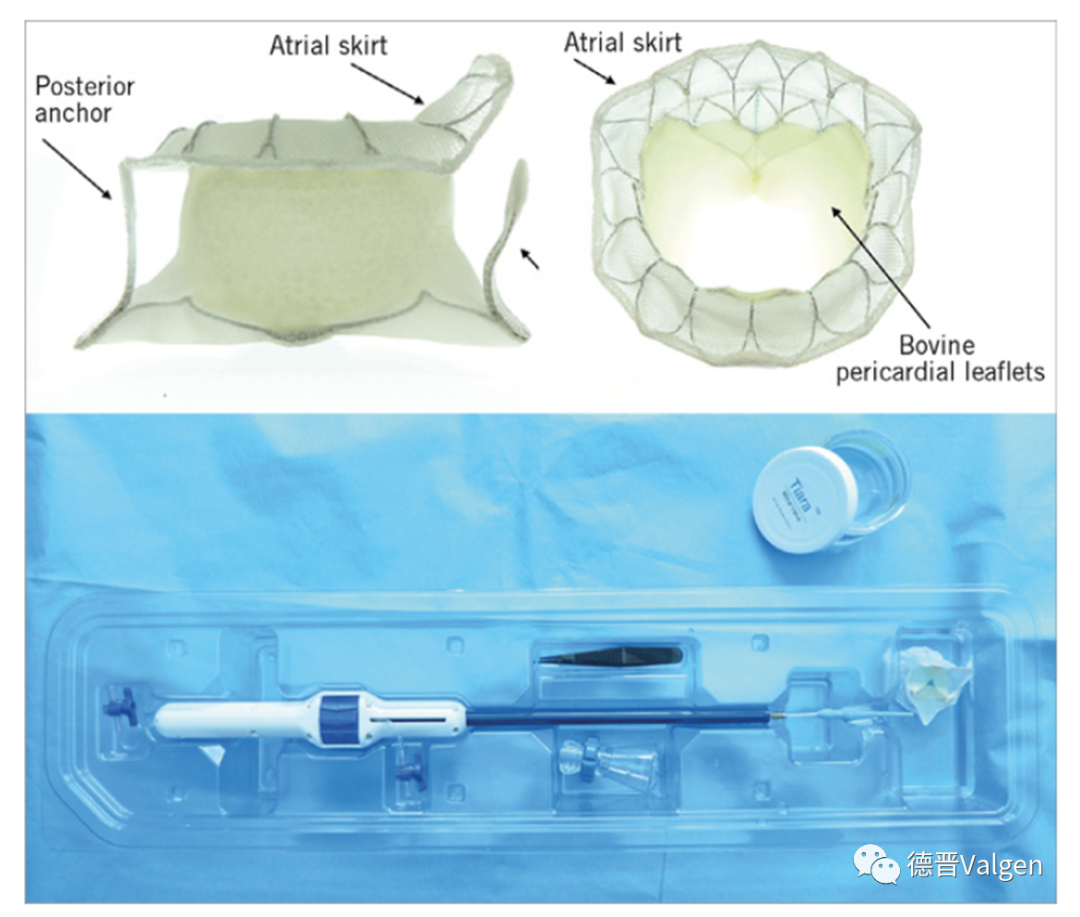
图7. Tiara经心尖二尖瓣置换系统
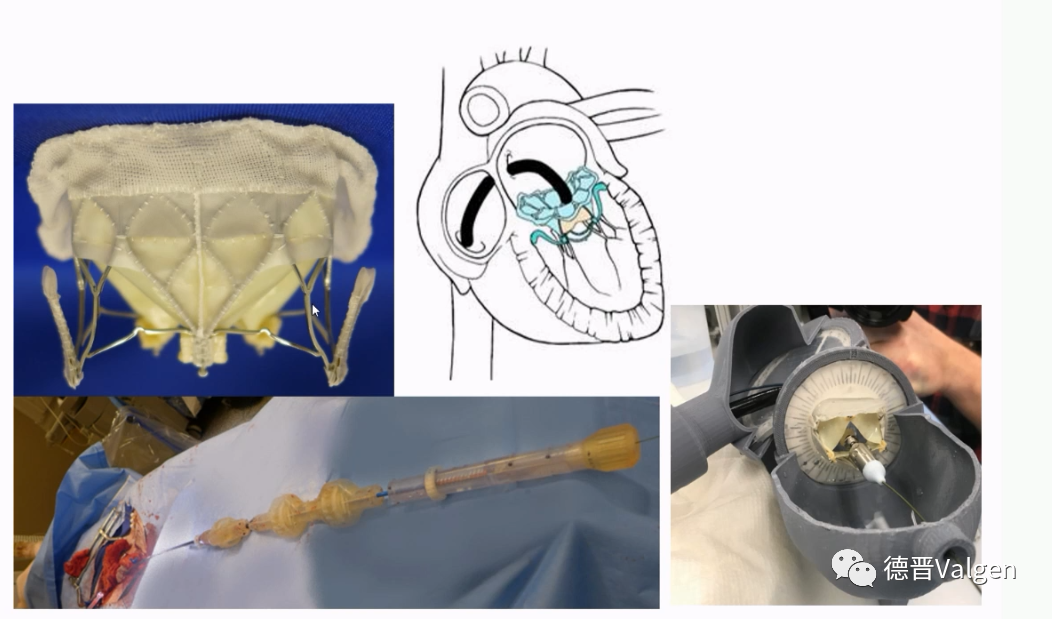
图8. Tiara经房间隔二尖瓣置换系统
Medtronic
Medtronic 早期自己开发了一个二尖瓣置换瓣膜(Medtronic TMVA)(图9),效果不佳,弃用后没有继续改进。

图9:Medtronic TMVA瓣膜
2015年Medtronic花了4.5亿美金收购Twelve Intrepid,该瓣膜的特点为双层瓣架结构,通过挤压外瓣架形成一个倒锥形提供锚定力,同时外瓣架侧壁上设计有的锚刺进一步提供锚定力。金属外层软支架及支架外层的软性锚定元件可适应自体二尖瓣环的可变性,并在整个心动周期内隔离内瓣环组件,确保内部支架瓣膜不被干扰(图10)。目前外支架有3种尺寸:43mm,46mm,50mm,用于适合不同大小及型态的二尖瓣瓣环。圆形内支架装有27mm的生物瓣膜。Intrepid瓣膜释放不需要旋转和方向定位,仅需要控制轴向及瓣膜释放深度,有助于降低手术操作难度。Intrepid TMVR输送系统目前采用的是经心尖路径,输送系统由心尖导引鞘(带扩张器)和液压驱动输送导管组成(图11)。

图10. Intrepid TMVR瓣膜设计

图11. Intrepid TMVR瓣膜输送系统
Intrepid瓣膜的临床试验结果同样令人失望。早期完成的全球初始队列研究(图12)中,纳入50例患者,手术成功率98%,但30天死亡率高达14%,3例死于心尖部出血(35F鞘管),3例死于心衰,1例死于瓣膜移位,1年死亡率23%。
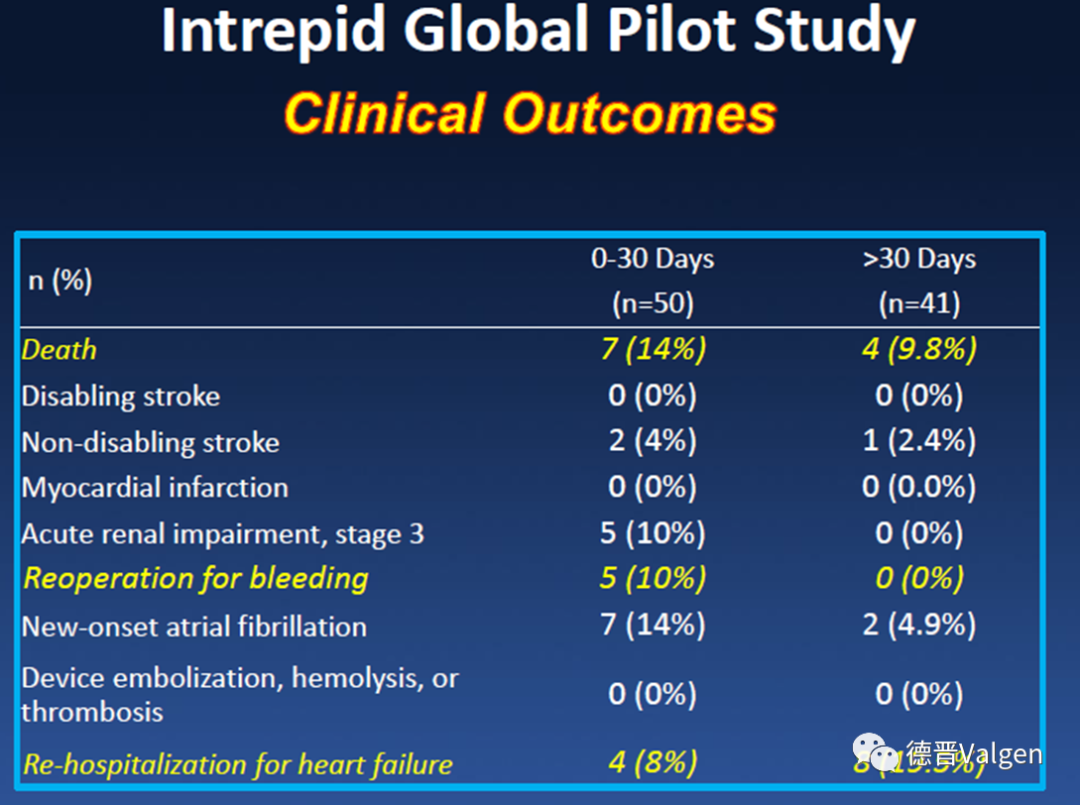
图12. Intrepid全球队列研究结果
Intrepid经房间隔路径(图13)方案是在其经心尖路径的基础上设计改进,其瓣膜内层支架优化了瓣叶及裙边缝合高度,从而降低了瓣膜装载时的应力,采用输送系统外径29F,以降低外周血管并发症风险,并在2019年完成了首例FIM。
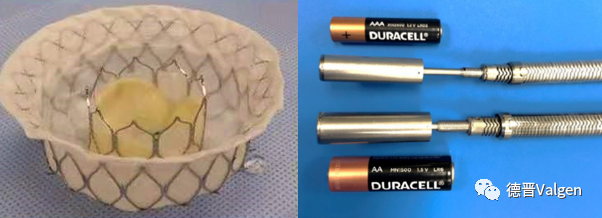
图13. Intrepid经房间隔路径瓣膜设计
Abbott
Tendyne瓣膜是目前唯一获得CE的二尖瓣置换瓣,2014年完成了首例FIM,2015年由Abbott 2.5亿美金收购,Tendyne瓣膜由自膨胀镍钛合金制成的双层支架和三叶猪心包瓣膜组成(图14)。外层支架为D形,内支架为圆形,有效孔面积大于3.2 cm2。通过密封垫将瓣膜固定于心尖部,以防支架瓣膜移位。Tendyne 瓣膜设计有以下优点(图15):①D型设计,符合二尖瓣口的解剖学形状,可避免出现左心室流出道梗阻(LVOTO)。②当对植入位置不满意或效果不理想时,可回收并重新释放或调整。③有心房轮缘,可避免瓣周漏。④更加重要的是,与其他几款瓣膜采用钳夹瓣叶或腱索组织固定不同,Tendyne瓣膜依靠心尖系绳固定,心尖系绳有拉力,可避免或减少瓣膜向心房侧移位,其在心室侧的支架外径逐渐向中心缩小,同时通过调整系绳位置使瓣膜偏向心室游离壁,减少LVOTO发生率;并且心尖密封垫也有助封堵入路伤口。

图14. Tendyne瓣膜
Tendyne瓣膜系统的临床试验结果同样历经曲折。2013年,在法国首先完成了两例经心尖置入Tendyne 瓣膜的人体试验。两例患者术前均为Ⅳ级二尖瓣反流,术后分别为无反流、Ⅰ级反流[7]]。2015 年,有学者报道 3 例三维经食道超声心动图引导下的经心尖Tendyne 瓣膜置入,3 例患者均为重度反流伴心功能不全的外科高危患者,手术过程均未出现并发症,术后复查 3 例患者反流全部消失,均好转出院[8]。前100 例患者植入成功率为96%,30天内死亡率为6%,1年死亡率为27.6%。
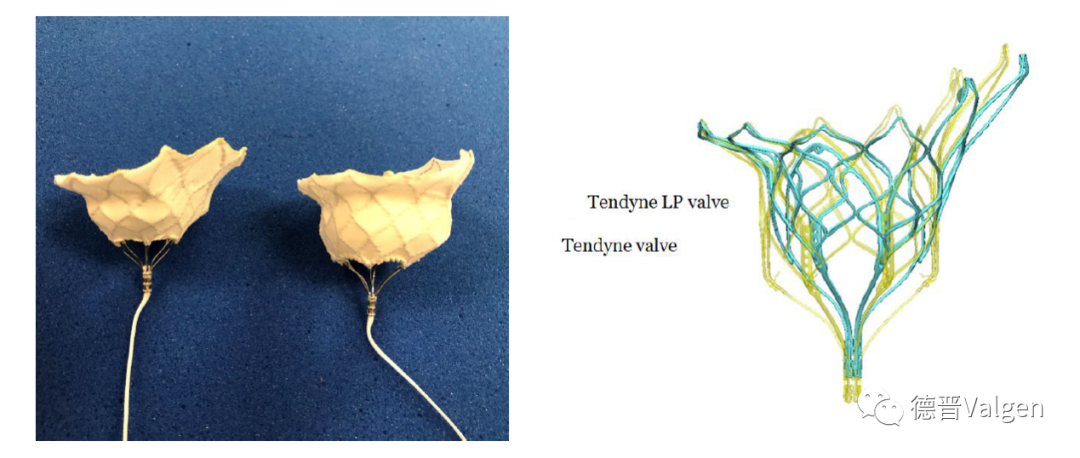
图15. Tendyne瓣膜
随着经验的不断积累,在此后的一项全球研究中完成了75例病例,均为外科手术高危的MR患者。手术成功率为80%,30天死亡率6.7%,瓣膜功能不良发生率6.7%(含1例瓣周漏,4例发生二尖瓣狭窄),终于,Tendyne瓣膜于2020年1月30日获得CE认证,成为介入二尖瓣置换领域为数不多的成功者。目前已设计出二代瓣膜,可降低左心室流出道梗阻可能性,新的临床试验在进行中。
2019年2月,Abbott收购了一款经房间隔二尖瓣置换瓣膜Cephea valve,该瓣膜采用双层瓣架结构,通过外瓣架的腰部内凹形成哑铃状结构,卡在瓣环位置,从而实现锚定(图16),目前该瓣膜已经累计植入7例。

图16. 经房间隔二尖瓣置换瓣膜Cephea valve
纵观已经完成的临床试验,经皮二尖瓣置换的领域里群雄逐鹿,过程异常艰辛曲折,但胜者寥寥,仅极少数突围获得成功,更多的是在半路折戟,项目停滞。此外,还有Cardiovalve 瓣膜、Endovalve 瓣膜,4C Medicalde Avalve瓣膜, Saturn TMVR瓣膜, EPYGON瓣膜, Opus Medica瓣膜等尚在临床前期试验中,我们期待着它们的表现。
国内二尖瓣置换现状
目前国内从事介入二尖瓣瓣膜置换开发的公司包括有纽脉医疗、以心医疗,健世生物,赛诺医疗,沛嘉医疗、微创医疗、启明医疗等,并取得了一定的进展和成绩,其中专注于二尖瓣的纽脉医疗和专注于三尖瓣置换的健世生物已经进入临床阶段,以心医疗二尖瓣置换已经完成首例FIM。
目前国内的二尖瓣置换瓣膜研究在结构上做了很多改进工作,并且做了大胆的尝试,从报道的信息来看,主要以经心尖路径为主要途径,即刻的效果对反流的减少均具有明显的改善,但是临床入组数较少,同时长期效果的数据缺乏。
讨论
为什么经导管二尖瓣置换领域获得成功如此艰难?分析原因主要是二尖瓣复杂的解剖结构。与经皮主动脉瓣置换(TAVI)技术相比,TMVR所面临的技术难度明显增加,存在诸多的困难与挑战。例如:二尖瓣病变、病因复杂;与主动脉瓣疾病相比,二尖瓣病变以关闭不全为主,而非狭窄;毗邻解剖结构复杂(冠状动脉、腱索、毗邻瓣膜等);瓣环通常无明显钙化以致瓣膜不易锚定;二尖瓣环为马鞍形,更大且随心动周期跳动,形态多变;在左心室收缩期瓣膜所受血流冲击力大;瓣周漏耐受性明显差;复杂的瓣下结构;影像更加复杂,手术入路更加复杂;左室流出道梗阻问题;更高的血栓形成风险,等等。同时每一种器械的结构特点不一样,需要严格根据瓣膜的结构特点来选择合适的病人,病人的入选率低。
优秀的TMVR器械设计需满足以下几个方面:合适的锚定设计;良好的产品密封性,避免瓣周漏;避免影响其他解剖结构;适应病变特点;符合血流动力学设计(瓣膜血流动力学);可回收;耐久性;人性化操作设计。
锚定方式是TMVR瓣膜设计的核心要素,也是不同TMVR产品的主要不同点。下图展示了几种瓣膜的锚定方式(图17)。
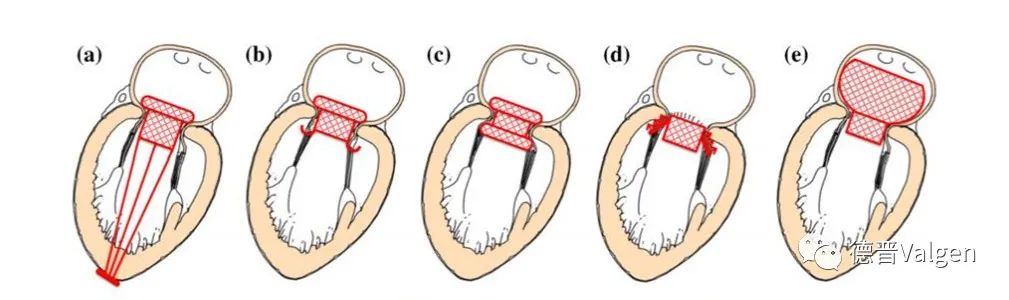
图17. 几种瓣膜的锚定方式
TMVR输送路径包括:经心尖入路,经股静脉穿刺房间隔入路、经左心房入路以及经股动脉主动脉逆行路径(图18)。在过去十年研究,二尖瓣置换临床上积累了一些经验,但同时可以看到,10年间二尖瓣置换累计入组数量不足800例,此患者中大部分采取的是经心尖手术路径,病人创伤较大,影响心室功能,相比于外科,经心尖路径二尖瓣置换不具备显著的优势,这可能是二尖瓣置换入组病人少的一个重要原因。经股静脉途径手术是TMVR的理想方法。但经股静脉途径不仅需要使瓣膜压缩至小尺寸输送系统中,同时要求输送系统具备高弯曲能力,并且输送系统需经房间隔通过特定角度到达二尖瓣,技术难度很高。
目前大多数TMVR系统采用经心尖途径输送。经心尖途径具有距离较短的优点,不受输送系统尺寸的限制、同时也可保证瓣膜能够对准释放位置。但近来研究表明经心尖途径进行 TMVR 的患者围术期并发症及死亡率更高 ,同时超声心动图和核磁共振检查的结果也显示经心尖途径容易损害左心室壁的运动和功能 。此外有研究认为经心尖途径易引起出血、损伤瓣下结构。从经导管二尖瓣修复的经验来看,股静脉-房间隔途径安全性更高、创伤更小、术后恢复快,增加手术的安全性 ,但经股静脉-房间隔 TMVR 于术后可能遗留潜在的房间隔缺损甚至需要经皮修复。随着TMVR 设计的不断改进,装置趋向小型化,有望不再遗留较大的房间隔缺损。
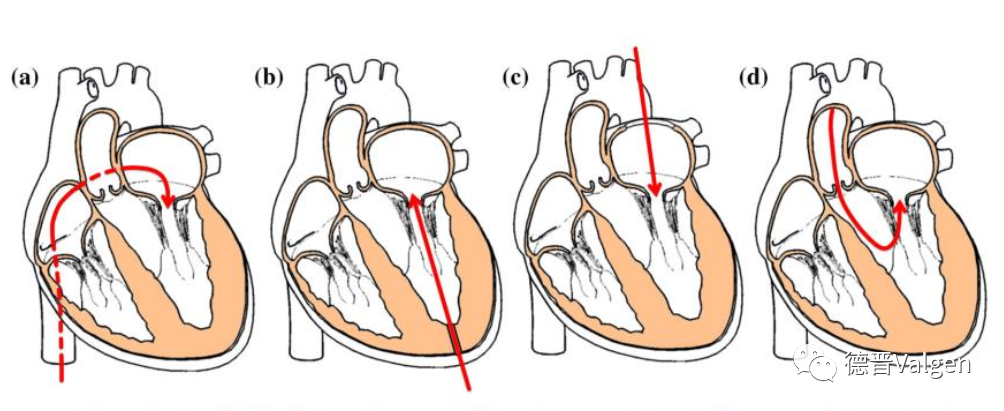
图18. 几种TMVR输送路径示意图
经皮二尖瓣置换和经皮二尖瓣修复如何选择?一方面取决于患者的二尖瓣病变特点和病变范围,另一方面取决于现阶段两种治疗技术的发展现状。在治疗范围上,二尖瓣置换主要适合于瓣膜受损严重或修复后复发的患者,例如风湿性心脏瓣膜病、合并二尖瓣狭窄、瓣膜严重钙化、挛缩、瓣下病变重、心内膜炎、无法使用成形手术纠正者;二尖瓣置换术近中期治疗效果更好,但远期存在生物瓣衰败的风险,同时也存在诸多的缺点和局限性,包括非生理性修复、破坏瓣下及瓣环结构,对心功能有负面影响,生存率更低;安全性较低,具有较高的并发症发生率(死亡、脑卒中、瓣周漏、左室流出道梗阻、医源性房间隔缺损、出血等)[9-11]。此外由于经皮二尖瓣置换的瓣膜体积较大,采取外周血管途径对输送系统提出了很高的技术要求。目前经导管二尖瓣置换的临床试验结果并不令人满意。
相比之下,经导管二尖瓣修复技术可选的种类更多,并已获得了非常充分的临床安全性和有效性数据,临床获益明显,二尖瓣修复技术在解剖结构上更大程度上保留了二尖瓣及其周围组织的生理结构。
以MitraClip®和Pascal®为代表的瓣叶缘对缘修复技术通过微创的方式真实呈现了外科Alfieri Stitch术式,使瓣叶“双孔化”,适合于器质性和功能性二尖瓣反流。2003年,St Goar等首先在猪身上通过开胸的方式成功完成了MitraClip®术,证明了其可行性。随后开展的EVEREST I、EVEREST lI系列研究以及TVT研究等结果均证实了MitraClip®术的安全性及有效性。2008年MitraClip®系统通过欧洲CE认证,并在2013年通过美国食品药品管理局审批。该技术在世界各地迅速开展,目前全球已完成超过100000例。由德晋医疗研发的DragonFly™是中国第一个经股静脉二尖瓣缘对缘修复产品,Dragonfly™早期探索性临床研究在浙大二院已成功完成5例手术,器械成功率和手术成功率高达100%。
另外以Neochord®为代表的人工腱索植入技术,通过人工腱索植入来治疗因瓣叶脱垂或腱索断裂导致的器质性二尖瓣反流,既往临床试验已充分证实了该技术的安全性和有效性。德晋医疗的MitralStitch®是中国第一款微创介入治疗二尖瓣反流的产品,于2018年1月份成功应用于人体临床。MitralStitch®可在心脏不停跳的情况下,经心尖途径实现人工腱索植入,可用于治疗中重度和重度二尖瓣反流。
综上,经皮二尖瓣修复在一定程度上优于经皮二尖瓣置换,经皮二尖瓣修复仍然是目前二尖瓣介入治疗的主要方式。而对于经导管二尖瓣置换产品,我们期待有结构设计更加合理、科学的新产品横空出世,实现经股静脉途径输送、锚定更加牢固、耐久性好、对左心室流出道影响甚小,且安全性高。
未来值得期待。

德晋医疗
杭州德晋医疗科技有限公司(以下简称“德晋”)成立于2015年,位于中国杭州国家高新技术产业开发区(滨江),在北京、上海和深圳均设有办事处。秉承立足中国、面向世界的企业发展战略,德晋专注于结构性心脏病领域尤其是二尖瓣和三尖瓣的相关治疗技术的研发,提供全球二尖瓣病变系统性解决方案。

参考文献
[1]. Romeo, F., et al., Trans-catheter mitral valve implantation for mitral regurgitation: clinical case description and literature review. J Cardiovasc Med (Hagerstown), 2016. 17(2): p. 85-91.
[2]. De Backer, O., et al., Percutaneous Transcatheter Mitral Valve Replacement. Circulation: Cardiovascular Interventions, 2014. 7(3): p. 400-409.
[3]. Sondergaard, L., et al., Transcatheter mitral valve implantation via transapical approach: an early experience †. European Journal of Cardio-Thoracic Surgery, 2015. 48(6): p. 873-878.
[4]. Cheung, A., et al., Short-Term Results of Transapical Transcatheter Mitral Valve Implantation for Mitral Regurgitation. Journal of the American College of Cardiology, 2014. 64(17): p. 1814.
[5]. Takagi, H., et al., Transcatheter mitral valve replacement for mitral regurgitation—A meta-analysis. Journal of Cardiac Surgery, 2018. 33(12): p. 827-835.
[6]. Søndergaard, L., et al., First-in-Human Case of Transfemoral CardiAQ Mitral Valve Implantation. Circulation: Cardiovascular Interventions, 2015. 8(7): p. e002135.
[7]. Anyanwu, A.C. and D.H. Adams, Transcatheter mitral valve replacement: the next revolution? J Am Coll Cardiol, 2014. 64(17): p. 1820-4.
[8]. Moat, N., et al., Transcatheter Mitral Valve Replacement for the Treatment of Mitral Regurgitation. Journal of the American College of Cardiology, 2015. 65(21): p. 2352.
[9]. Blackstone, E.H., et al., Propensity-Matched Comparisons of Clinical Outcomes After Transapical or Transfemoral Transcatheter Aortic Valve Replacement. Circulation, 2015. 131(22): p. 1989-2000.
[10]. Forsberg, L.M., et al., Differences in recovery of left and right ventricular function following aortic valve interventions: a longitudinal echocardiographic study in patients undergoing surgical, transapical or transfemoral aortic valve implantation. Catheterization and cardiovascular interventions : official journal of the Society for Cardiac Angiography & Interventions, 2013. 82(6): p. 1004-1014.
[11]. Ribeiro, H.B., et al., Predictors and Impact of Myocardial Injury After Transcatheter Aortic Valve Replacement. Journal of the American College of Cardiology, 2015. 66(19): p. 2075.